Moku:Pro在华盛顿大学受激拉曼散射显微成像应用案例
▍概述
Moku:Pro的锁相放大器(LIA)为受激拉曼散射(SRS)显微镜实验中的自外差信号检测提供了直观、精确和稳健的解决方案。高质量的LIA具有调制传输检测方案,是SRS显微镜实验中的关键硬件组件。在这个更新的案例研究中,我们提供了关于双LIA应用的详细信息和描述。
▍什么是受激拉曼散射显微成像?
SRS是一种相干拉曼散射过程,允许同时具有光谱和空间信息的化学成像。
(1)它使用两个同步脉冲激光,即泵浦和斯托克斯(图1),相干激发分子的振动。当入射在样品上的两个激光的频率差与目标分子的振动频率相匹配时,就会发生SRS过程。振动激发的结果是泵浦光束将损失光子,而斯托克斯光束将获得光子。当检测到泵浦光束的损失时,这称为受激拉曼损失(SRL)检测。强度损失ΔI/I通常在10(-7)-10(-4)量级,远小于典型的激光强度波动。为了克服这一挑战,需要一种高频调制和相敏检测方案来从噪声背景中提取SRS信号。
(2)在SRL检测方案中,斯托克斯光束以固定频率调制,由此产生的调制转移到泵浦光束由LIA检测。
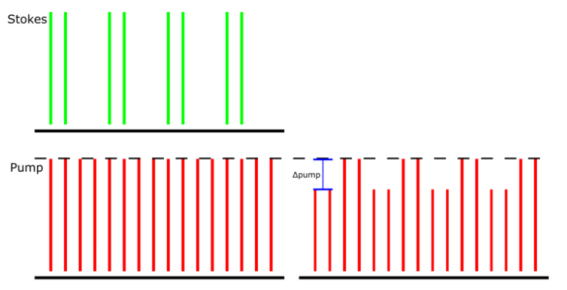
图1:受激拉曼损耗检测方案.。检测到由于SRS导致的斯托克斯到泵浦光束的调幅转移。演示的泵浦光束具有80 MHz的重复频率,斯托克斯光束具有相同的80 MHz重复但也在20 MHz时调制,Δ泵浦是LIA在此检测方案中提取的。
▍仪表显示
所用激光系统能够输出两个80MHz的激光脉冲串:斯托克斯光束在1030nm,泵浦光束在790nm。激光输出还用于同步调制:80MHz基准被发送到分频器以产生20MHz TTL输出。这20MHz输出被利用两次:一次作为电光调制器的驱动频率来调制斯托克斯光束,一次作为基准输入LIA的输入通道2(In B)用于外部锁相环。泵浦光束由硅光电二极管检测,然后发送到LIA的输入通道1(In A)。输出通道1(Out A)的信号被发送到数据采集卡以进行图像采集。输出通道2(Out B)的信号最小化(通过调整相移)。
▍单通道锁定放大器配置
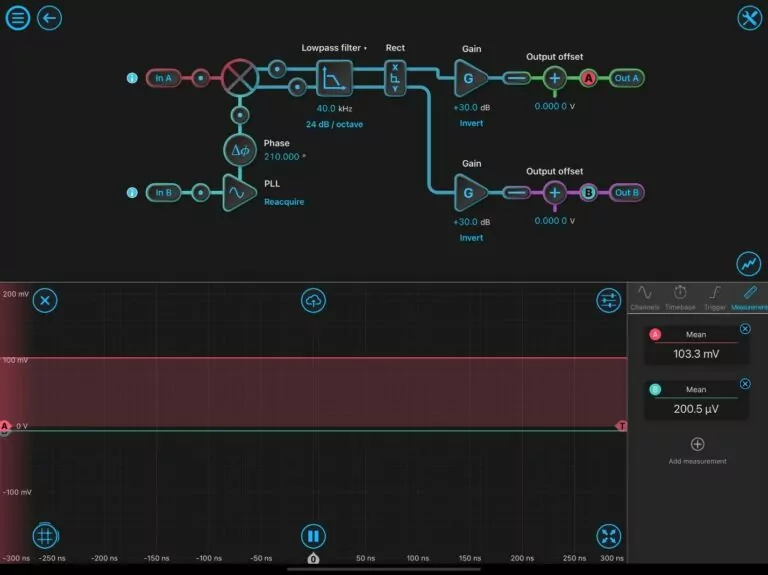
图2:典型的锁定放大器配置设置。
图2展示了LIA的在SRS显微成像实验中的初始设置。在初始设置时,必须重新获取锁相环。输入都配置为AC: 50欧姆。通过调整相位度数来优化相移(Df),直到Out A最大化(正值),Out B最小化(接近零)。探针A显示与DMSO的最高信号峰值(2913 cm(-1))相对应的SRS信号,并经由Out A输出最大值103.3 mV。探针B指示正交输出,最小化为零。一旦LIA针对溶剂校准进行了优化,样品就可以成像了。
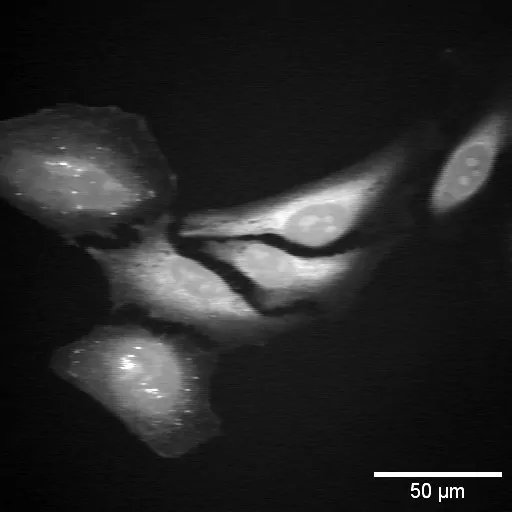
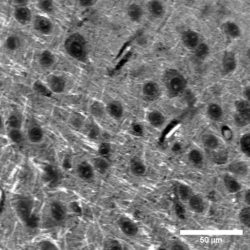
图3:2930 cm(-1)拉曼过渡处的SRS HeLa细胞图像。
图3是使用Moku: Pro锁相放大器拍摄的HeLa细胞图像。所示图像以2930 cm(-1)(对应于蛋白质峰)的拉曼位移从SRS图像中生成的。低通滤波器设置为40 kHz,对应于〜4µs的时间常数。增益可以根据SRS信号大小增加或减少。
▍双通道成像
Moku: Pro的LIA也可以适用于实时双色SRS成像。这是通过在SRS成像中应用正交调制并检测LIA的X和Y输出来实现的。(3)在这种情况下,斯托克斯调制有两个部分:一个20 MHz脉冲串生成SRS信号,另一个20 MHz脉冲串具有90°相移,生成另一个针对不同拉曼频段的SRS信号。由于90°相移,两个通道(Out A和Out B)彼此正交,并且可以在没有干扰的情况下同时获取两个SRS图像。
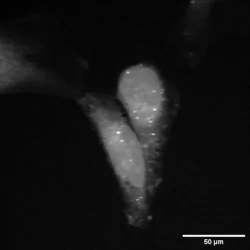
2850 cm(-1)脂质 2930 cm(-1)蛋白质
图4:使用正交调制和输出的两个不同拉曼转换下小鼠大脑样本的同时双通道SRS图像。图4是利用双通道X&Y输出同时在2930 cm(-1)和2850 cm(-1)处生成的两个SRS图像的代表性图像。
▍多仪器模式应用
在大多数SRS显微成像实验中,由于激光总带宽的限制,光谱范围被限制在约300 cm(-1)。绕过这一技术障碍的一种方法是用可调激光扫描波长。然而,波长调谐很慢,并且通常不足以进行时间敏感的实验,例如活细胞成像。应对这一挑战的另一种解决方案是引入第三束激光束来扫描不同的拉曼过渡区域。这种能力对于两个光谱区域同时成像特别有吸引力:一个在指纹区域(例如酰胺振动约1600厘米(-1)),一个在C-H区域(例如蛋白质约2900厘米(-1))。在SRL成像方法中,实验装置由一个斯托克斯光束和两个具有不同波长的泵浦光束组成。这种装置的通常检测方法需要单独的探测器和单独的LIA。然而,Moku: Pro的多仪器模式允许部署多个LIA,因此第二个LIA可以在不需要任何额外硬件妥协的情况下实现。
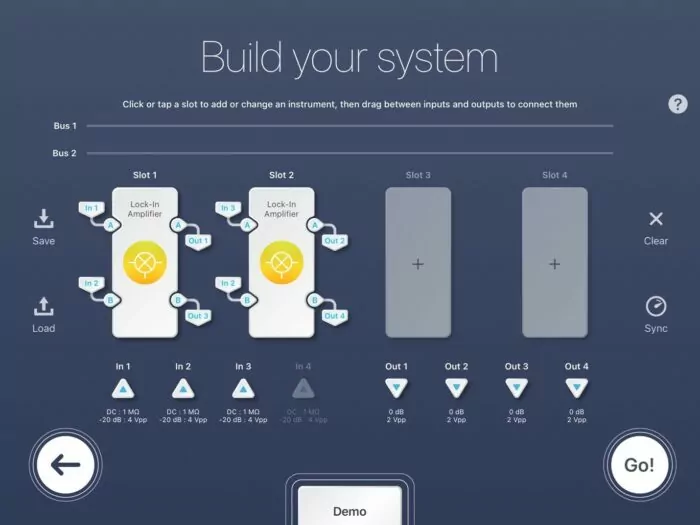
图5:Moku:Pro多仪器锁相放大器配置。
图5演示了LIA用于同时SRS显微镜实验的的多仪器模式设置。对于插槽1,In 1是第一光电二极管的检测信号,In 2是基准,Out 1是发送到数据采集卡的信号,Out 3被丢弃。对于插槽2,In 3是第二光电二极管的检测信号,In 2再次是基准,Out 2是发送到数据采集卡的信号,Out 4被丢弃。此配置仅使用4个Moku插槽中的2个。插槽3和4未分配,因此可用于进一步的LIA或任何其他Moku仪器。输入均配置为AC: 50欧姆。每个LIA插槽(1和2)遵循与单通道LIA配置相同的设置。发送到数据采集卡的每个检测信号(输出1和2)应通过调整其各自的相移来最大化。
在三个激光器的情况下,Moku: Pro的多仪器模式可以配置两个锁定放大器,将系统简化为一个设备而不影响功能。这允许研究人员同时拍摄两个大波数差的SRS图像,利用一个Moku: Pro处理两个光电二极管探测器信号。
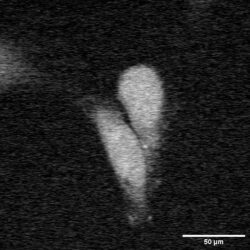
2930 cm(-1)蛋白质 2930 cm(-1)蛋白质
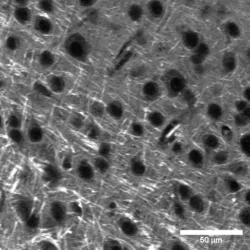
图6:在相距甚远的拉曼跃迁处使用多仪器设置拍摄的HeLa细胞SRS图像。
图6是利用一个Moku: Pro处理两个光电二极管探测器信号同时拍摄两个大波数差SRS图像的代表性图像。
▍结论
Moku: Pro的LIA为众多SRS显微成像实验提供了出色的解决方案。在本文档中,讨论了典型的单通道SRS成像、双通道成像和多仪器成像。用户交互界面允许直观而强大的控制来提取低强度SRS信号。重要的是,Moku: Pro的多仪器工具功能允许在不可变动的紧凑系统上进行复杂的成像实验。

图7:使用中的多仪器模式下的Moku: Pro图像。In 1和In 3分别是插槽1和插槽2中LIA的信号输入。In 2是两个LIA插槽的参考。在所示配置中,Out 1和Out 3是记录信号,Out 2和Out 4是插槽1和2的转储信号。
▍参考文献
1. Freudiger, W.; Min, W.; Saar, B. G.; Lu, S.; Holtom, G. R.; He, C.; Tsai, J. C.; Kang, J. X.; Xie, X. S., 受激拉曼散射显微成像的无标记高灵敏度生物医学图像。Science 2008,322(5909),1857-1861。
2. Hill, H.; Fu, D.,使用受激拉曼散射显微成像的细胞图像。Analytical Chemistry 2019,91(15),9333-9342。
3. Figueroa, ; Hu, R.; Rayner, S. G.; Zheng, Y.; Fu, D.,受激拉曼散射的实时微尺度温度成像。The Journal of Physical Chemistry Letters 2020,11(17),7083-7089。
——华盛顿大学化学系Brian Wang和Dan Fuls供稿
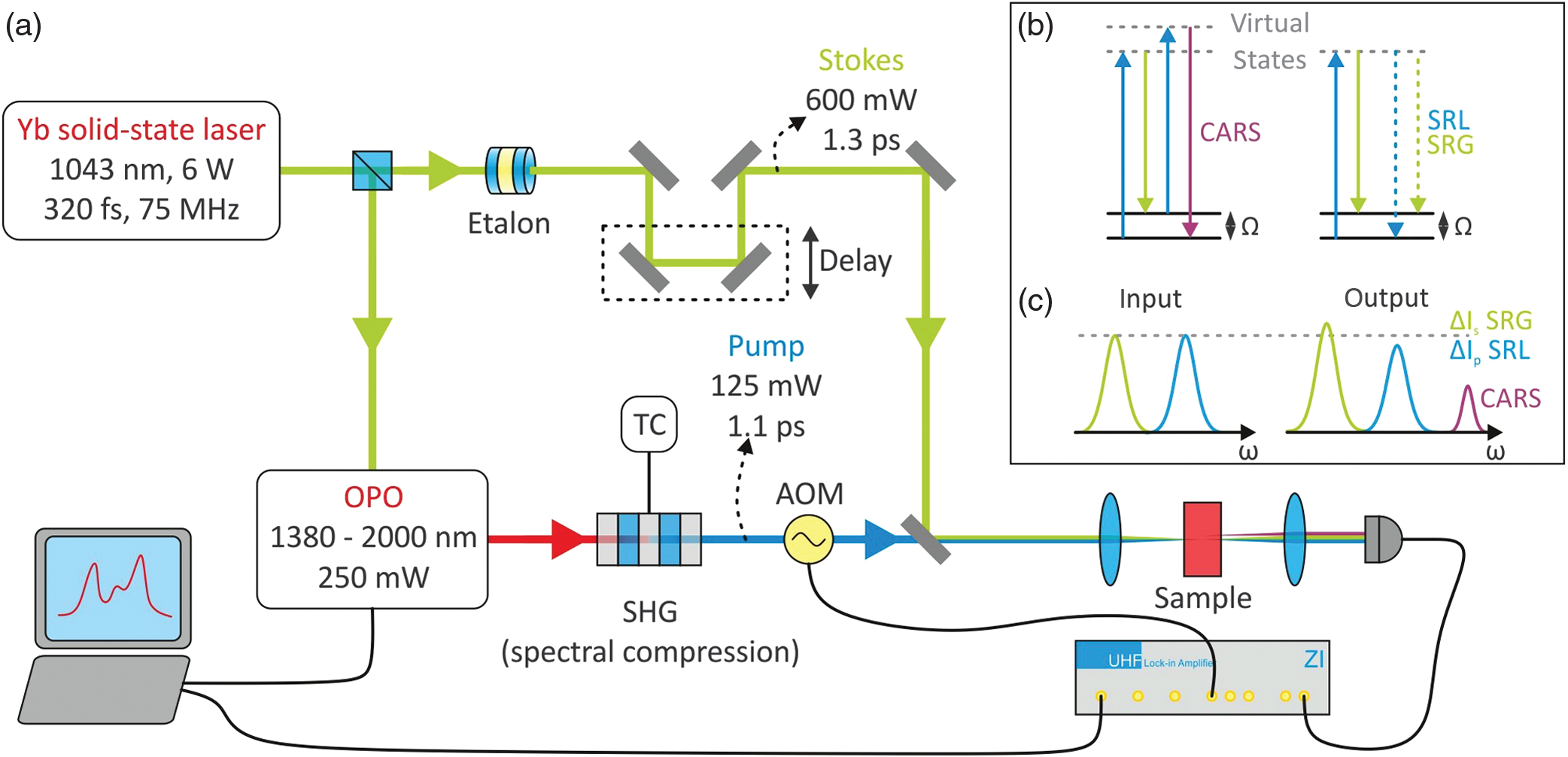 用于相干拉曼显微成像和受激拉曼显微成像的低噪声快速调谐光源
用于相干拉曼显微成像和受激拉曼显微成像的低噪声快速调谐光源  Moku:Lab锁相放大器在微弱信号检测应用及技术参数
Moku:Lab锁相放大器在微弱信号检测应用及技术参数  Moku:Lab电源稳定性分析-频率响应分析仪应用指南
Moku:Lab电源稳定性分析-频率响应分析仪应用指南  Moku:Lab 锁相放大器在受激拉曼散射显微镜的应用
Moku:Lab 锁相放大器在受激拉曼散射显微镜的应用  Moku:Lab客户案例-山东大学海洋研究院高性能激光稳频方案
Moku:Lab客户案例-山东大学海洋研究院高性能激光稳频方案